Definition: Le syndrome de Brugada
Il s’agit d’une maladie génétique responsable de troubles du rythme cardiaque à l’étage ventriculaire, décrite pour la première fois en 1992 par 2 frères, Pedro et Joseph Brugada.
Elle est caractérisée par :
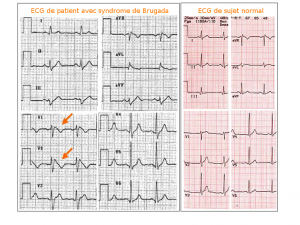
– un aspect anormal de l’électrocardiogramme (sus-décalage en dôme du segment ST suivi d’une onde T négative sur les dérivations V1 et V2),
– associé à un risque de syncope voire de mort subite par fibrillation ventriculaire,
– alors que le cœur est structurellement sain.
Figure 1 : Aspect ECG du syndrome de Brugada type 1 avec sus décalage du segment ST en dôme > 2 mm suivi d’une onde T négative.
Fréquence
La fréquence de la maladie est de l’ordre de 5 pour 10.000 habitants, pouvant aller jusqu’à 1/1000 habitants dans les pays asiatiques. Il est d’ailleurs désormais admis que le syndrome de Brugada et le syndrome de mort subite inexpliquée (SUDS) endémique en Asie du sud-est correspondent à une même entité.
On estime que le syndrome de Brugada serait responsable de 4 à 12% des 60 000 morts subites survenant chaque année en France.
Quelle cause?
Le syndrome de Brugada est responsable d’un dysfonctionnement « purement électrique » du cœur qui a par ailleurs une morphologie normale, sans anomalie de sa contraction.
Il existe soit des cas « sporadiques » de la maladie c’est-à-dire apparition d’un nouveau cas sans antécédents familiaux, soit des cas « familiaux » transmis selon un mode « autosomique dominant ». Cela signifie que le gène anormal peut se transmettre à la descendance avec un risque de 50% pour chaque enfant, et un risque équivalent pour les garçons et les filles.
En 2009, grâce à l’observation de grandes familles atteintes du syndrome, 7 gènes imputés dans la maladie avaient pu être identifiés. Le premier à avoir été caractérisé est le gène SCN5A. Il assure la fabrication d’une partie du canal sodique, qui a un rôle majeur dans l’activité « électrique » des cellules cardiaques. Les mutations de ce gène sont responsables d’une altération du fonctionnement du canal sodique.
Symptômes: Le syndrome de Brugada
Tous les patients présentant l’anomalie électrocardiographique du syndrome ne présenteront pas obligatoirement des symptômes. En effet la pénétrance est faible, c’est à dire que parmi les personnes ayant une mutation, peu présenteront les signes cliniques de la maladie.
Certains patients ne ressentent aucun symptôme. Les autres ressentent des symptômes en rapport avec la survenue de troubles du rythme (anomalie du rythme ventriculaire, sous la forme d’un emballement du cœur). Les aspects cliniques sont très variables pouvant prendre l’apparence de malaise d’allure vagale chez des sujets apparemment en pleine santé.
Le diagnostic est évoqué devant la survenue de lipothymies ou syncopes.
Une des caractéristiques est que les symptômes surviennent le plus souvent au repos ou la nuit (pertes d’urine inexpliquées chez un adulte par exemple ou une respiration stertoreuse). Ces symptômes peuvent être favorisés par un épisode de fièvre.
Les troubles du rythme cardiaque peuvent survenir à tout âge (le plus souvent le premier épisode clinique se manifeste vers l’âge de 40 ans) et sont plus présents chez les hommes que chez les femmes (H/F : 10/1)
Comment fait-on le diagnostic?
Le syndrome de Brugada doit par définition inclure :
– Un aspect ECG de type 1 spontané, ou induit par test pharmacologique (après avoir éliminé les causes pouvant mimer cette anomalie de l’ECG : prise de certains médicaments, anomalies du bilan sanguin, pathologies cardiaques aiguës ou chroniques…),
– Des symptômes (mort subite, lipothymies, syncopes) ou des antécédents familiaux de mort subite,
– Un cœur structurellement normal (nécessitant la réalisation d’une échographie cardiaque).
Si un patient présente simplement un ECG suspect de syndrome de Brugada, il faudra réaliser un test pharmacologique avec injection intra-veineuse par une perfusion d’un médicament (en France on utilise l’ajmaline ou la flécaïne) qui permettra de démasquer un véritable aspect de syndrome de Brugada. Ce test est réalisé par l’équipe de rythmologie au cours d’une hospitalisation ambulatoire avec surveillance du rythme cardiaque pendant quelques heures.
A l’issue de ce test, le diagnostic de syndrome Brugada sera retenu ou écarté définitivement sans autre examen ou surveillance nécessaires.
QUEL BILAN?
Il s’agit d’évaluer le risque de complication (trouble du rythme ventriculaire).
Pour les patients ayant déjà présentés une mort subite ou une syncope, le risque de récidive d’un évènement clinique est élevé et le patient doit bénéficier de l’implantation d’un défibrillateur sans qu’aucun bilan complémentaire ne soit nécessaire.
Pour les patients n’ayant aucun symptôme on peut s’aider de la réalisation d’une exploration électrophysiologique avec stimulation ventriculaire pour voir si l’on déclenche un trouble du rythme ventriculaire. Il s’agit d’introduire par voie veineuse (veine fémorale) une sonde qui va jusqu’à l’intérieur des cavités cardiaques (ventricule droit), et d’étudier la réponse du cœur à une stimulation électrique. L’examen est réalisé sous anesthésie locale, en hospitalisation ambulatoire (quelques heures de surveillance avant le retour à domicile).
Évolution
Le risque est la survenue d’un trouble du rythme ventriculaire avec fibrillation ventriculaire (rythme cardiaque rapide et anarchique) évoluant vers le décès brutal. Cet événement est difficilement prévisible.
Les patients ayant déjà présenté une mort subite ont un risque élevé d’en présenter une à nouveau (20 à 60%). Les symptômes tels que lipothymies et syncopes représentent aussi un signe d’alarme majeur : le risque de présenter une mort subite est alors de 6 à 19%. L’ensemble de ces patients doit donc bénéficier de l’implantation d’un défibrillateur.
Les patients sans symptômes (asymptomatiques) ont quant à eux un risque de survenue de fibrillation ventriculaire faible (<1%). Les facteurs admis comme étant associés à un pronostic défavorable sont principalement : un aspect ECG type 1 spontané, le sexe masculin, et l’histoire familiale de mort subite. Ces patients requièrent une surveillance clinique régulière et doivent contacter leur cardiologue en cas d’apparition de symptômes.
Traitement: Le syndrome de Brugada
Il existe un consensus actuel pour proposer aux patients symptomatiques l’implantation d’un défibrillateur automatique. Le défibrillateur surveille en permanence le rythme cardiaque et délivre un choc électrique s’il détecte la survenue d’une fibrillation ventriculaire ce qui permet de restaurer un rythme cardiaque normal.
Les patients sans symptômes ont un risque de mort subite beaucoup plus faible. Dans la majorité des cas il ne sera pas nécessaire de leur implanter un défibrillateur automatique.
La fièvre peut majorer l’anomalie et favoriser la survenue de trouble du rythme. Il est donc important de recourir aux médicaments antipyrétiques en cas de fièvre.
Enfin certains médicaments peuvent aussi majorer l’anomalie et favoriser les troubles du rythme : ces médicaments sont donc formellement contre indiqués et il faut être vigilant lors de la prise de tout nouveau traitement (fiche des médicaments contre indiqués).
Surveillance?
Les patients jusqu’alors asymptomatiques doivent surveiller l’apparition de tout symptôme nouveau et le signaler à leur cardiologue. Il est également utile de faire un électrocardiogramme tous les ans en l’absence de nouveaux symptômes.
Les patients porteurs d’un défibrillateur doivent être suivis en consultation spécialisée tous les 6 mois et doivent consulter très rapidement en cas de survenue d’un choc électrique délivré par l’appareil.
Peut-on faire du sport lorsque l’on est porteur d’un Syndrome de Brugada?
Certaines activités sportives sont déconseillées : escalade, plongée… néanmoins la pratique sportive a rarement des conséquences défavorables puisque les symptômes surviennent principalement au repos ou pendant le sommeil.
Peut-on mener une grossesse a terme lorsque l’on a un Syndrome de Brugada?
Le syndrome de Brugada n’influe pas sur la fertilité et ne contre-indique pas la grossesse. Les patientes ayant un défibrillateur devront être suivies de façon plus rapprochée par l’équipe de rythmologie.
Quel Bilan Familial?
Compte tenu de la transmission de la maladie sur le mode autosomique dominant, un sujet porteur de la mutation pourra la transmettre à ses descendants avec une probabilité de 50% pour chaque enfant.
Le syndrome de Brugada doit être recherché chez tous les apparentés au premier degré (parents, frères et sœurs, enfants) de tout sujet atteint du syndrome. Le bilan familial doit comporter au minimum un enregistrement ECG, et il peut être complété par un test pharmacologique.
En ce qui concerne les jeunes enfants, l’ECG est d’interprétation plus difficile pour poser le diagnostic. L’âge du premier bilan ne fait pas l’objet de consensus. Un ECG peut être réalisé dès le plus jeune âge pour certains, ou pour d’autres seulement à partir de la puberté.
Intérêt du test génétique?
Le test génétique consiste à faire une prise de sang, pour analyser l’ADN, et rechercher l’anomalie génétique (mutation) responsable de la maladie dans la famille.
Actuellement, on trouve une mutation chez seulement 1 patient /5 atteint du syndrome de Brugada, toutes les mutations et tous les gènes responsables du syndrome n’ayant pas encore été identifiés.
L’intérêt du test, quand une mutation est identifiée va être de pouvoir rechercher plus facilement la même mutation au sein de la famille pour déterminer qui est porteur ou non du syndrome. En revanche ce test n’a aucune utilité en terme de stratification de risque, il ne permettra pas de savoir si un patient atteint a plus de risque ou non de présenter une fibrillation ventriculaire.
SOURCE: Centre de Référence pour les Maladies cardiaques héréditaires


